研究概要
哺乳類ゲノムの半分近くはレトロトランスポゾンとよばれるゲノム内を移動(転移)する転移因子由来の配列から成り立っています。これらはゲノム進化を促す原動力にもなれば遺伝子破壊やゲノム不安定化によって疾患を引き起こす原因にもなります。私たちの研究室では、特にヒトゲノムにおいて頻繁に転移するLINE-1やSINEレトロトランスポゾンがどのように転移するのか、その動態制御に着目して研究を進めています。また、レトロトランスポゾンは発生や老化制御、免疫応答にも深く関与することがわかってきており、これらの高次生命現象との関わりについても研究を行っています。将来的には、レトロトランスポゾンを人為的に制御する技術を確立することによって、これらが関与する疾患の緩和や抑制につながる手法の開発を目指します。
レトロトランスポゾンとは何か?
トランスポゾン(転移因子)は、ゲノム上を移動する可動性の因子であり、大きく分けてカット&ペーストで動くDNAトランスポゾンと、コピー&ペーストで移動するレトロトランスポゾンに大別されます。我々のグループではヒトゲノムで唯一自律的に転移することが可能なLong INterspersed Element-1 (LINE-1またはL1)およびL1を利用して転移するAluやSVAなどを含むShort INterspersed Element (SINE)ファミリーと呼ばれるレトロトランスポゾンに着目し、どのようにゲノム上を伝播していくのか、その分子機構と細胞に与える影響について研究を行っています。
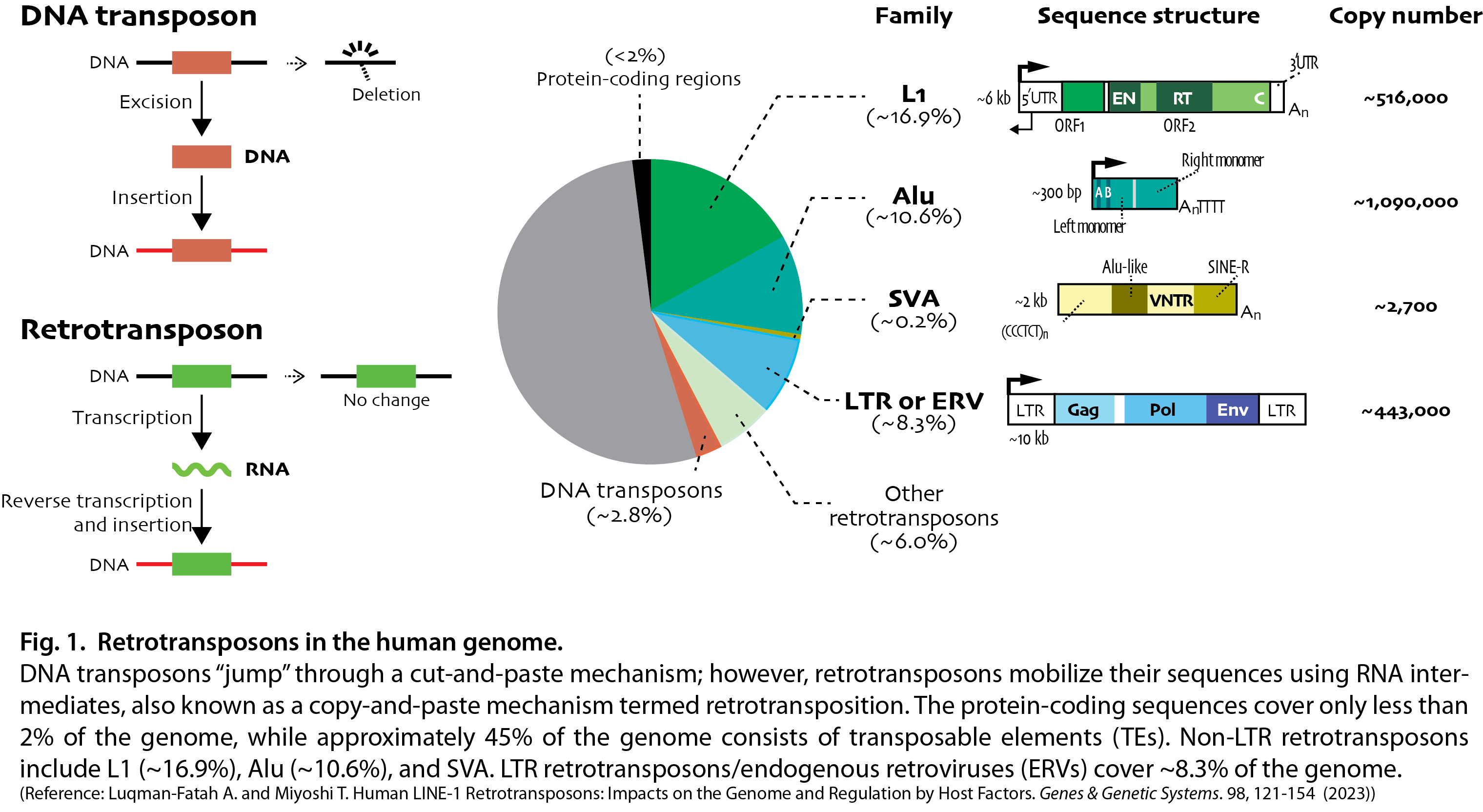
我々のゲノムの半分近くは種々のトランスポゾン由来の配列から成り立っています。上記で述べたL1はヒトゲノムの約17%を占めておりますが、多くの配列が変異や欠失によって転移する能力を失っています。しかし約80-100コピー程度のL1は、現生人類のゲノム上を今でも活発に“ジャンプ”していると推定されています。転移の結果何が起こるのか?まず個体間のゲノムバリエーションを生み出します。例えばAさんとBさんのゲノム上のレトロトランスポゾンの挿入位置は異なるかもしれません。レトロトランスポゾンが生殖細胞で高発現であることも、これを後押しします。また、個体内でのゲノムモザイク化も起こります。つまりある個体の細胞間を比べると、ある細胞ではレトロトランスポゾンが転移して別の細胞では転移していない―ゲノム構造に変化が生じます。現在までに初期胚や脳の神経前駆細胞で転移がよく起こると報告されており、このモザイク化は十分説得力があります。
このようなゲノム構造変化は、細胞機能を亢進するメリットや長期的な視点でみれば進化を促す原動力にもなり得ますが、短期的には遺伝子破壊をも引き起こす諸刃の剣であると考えられます。例えばこれまでに血友病、筋ジストロフィー、ある種のがんなどL1やSINEファミリーが転移した結果、重要な遺伝子が破壊されて疾患につながるケースが100例以上報告されています。
細胞内の因子がレトロトランスポゾンの転移を制御
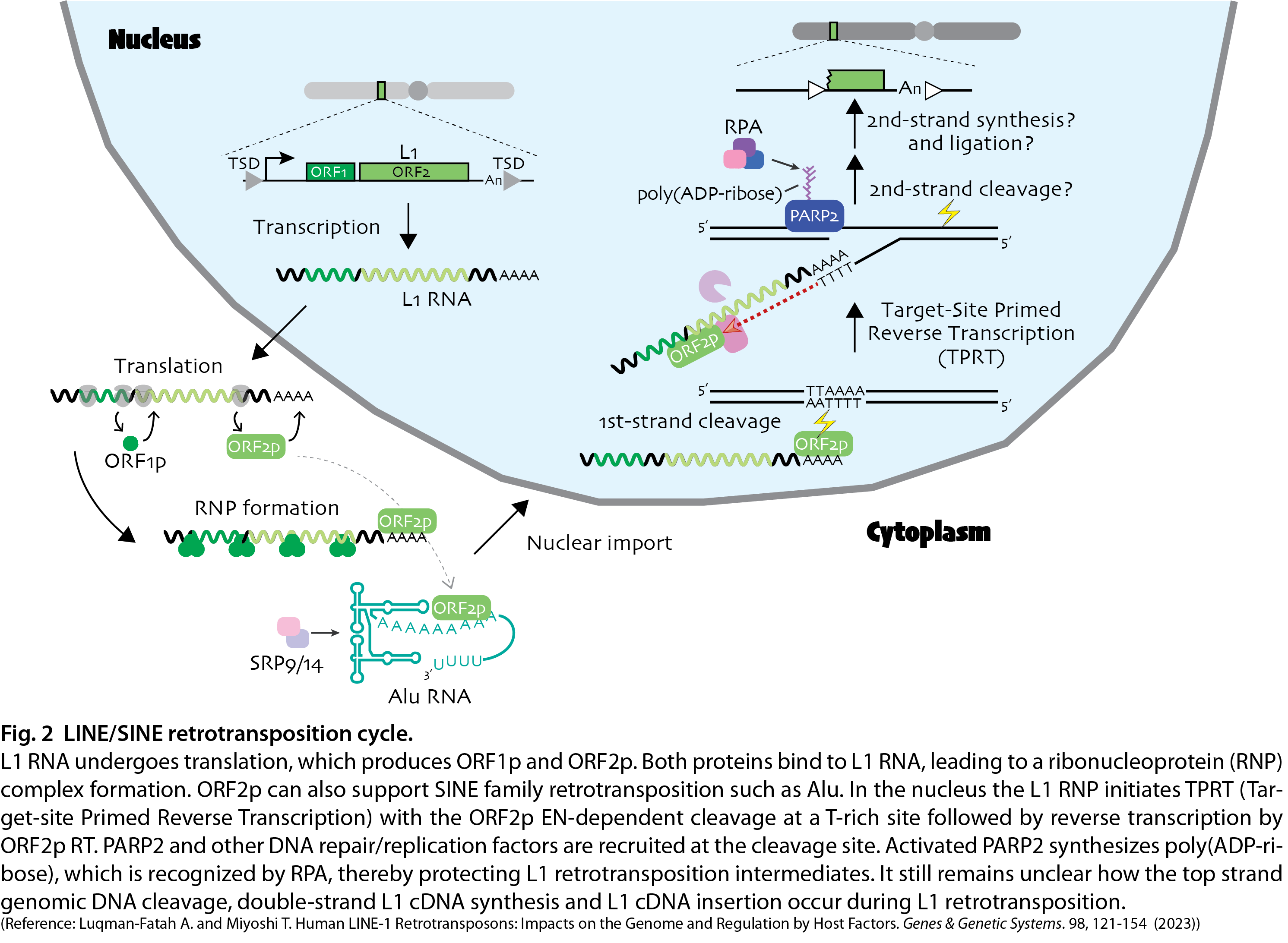
L1は1つのmRNA上から2種のタンパク質(ORF1とORF2)が作られる非常に特殊な因子です。ORF1はRNA結合能を有しますがその詳細な役割はまだよく分かっていません。一方でORF2はDNAを切断するエンドヌクレアーゼと自身のRNAをDNAに変換する逆転写酵素活性を有します。つまりL1の触媒サブユニットとして機能します。ORF1とORF2は翻訳された後、L1のRNAと複合体を形成し、これがゲノムDNA上に切断を入れてニック(一本鎖切断)を作り出すと考えられています。このニックの3’側のDNA端からORF2は逆転写を開始し、L1 RNAをcDNAに変換します。この過程をTarget-site Primed Reverse Transcription (TPRT)と呼びます。しかし、ニックの導入から最終的にL1のDNA配列がゲノムに挿入されるまでの詳細な過程はまだ良くわかっていません。またSINEファミリーであるAluは、L1の逆転写酵素であるORF2を利用することで転移する非自律的な (自らだけでは転移することができない)レトロトランスポゾンです。興味深いことにこのAlu配列はL1よりも高い頻度でゲノム内をジャンプすると予測されていますが、その転移制御機構はL1よりもわかっていません。
レトロトランスポゾンによってDNA上にこのような損傷が入れば、細胞側もだまっていません。DNA修復タンパク質が損傷部位を修復することが想定されますし、あるいは細胞にとって危険なレトロトランスポゾンそのものを分解する因子を動員することも予想されます。つまり、レトロトランスポゾンという利己的な遺伝子を制御するために、細胞側は“宿主”として対応に迫られるわけです。このレトロトランスポゾンと宿主因子の絶妙なやりとりの上に、我々のゲノム恒常性のバランスが保たれていると考えらます。
レトロトランスポゾンを制御する因子は、DNA修復因子であればもちろんDNA損傷の修復という重要な細胞内の機能があるように、他の因子群にも細胞の恒常性を維持する役割があります(例えば一部の抗ウィルス因子はL1の分解も促進)。そこでレトロトランスポゾンの転移がどのような分子機構―特に宿主因子との連携あるいは攻撃―の上に成り立っているのを知ることで、レトロトランスポゾンそのものの振る舞いを理解できるだけでなく、これに関わる宿主因子の知られざる役割を明らかにできると考えられます。実際、我々が見つけたL1と相互作用するDNA修復因子の1つは、これまでその役割がよく分かっていなかったものの、TPRT中間体における作用機序を明らかにする過程で、新しい分子機構が分かってきました。また自然免疫応答にかかわる多くの因子がL1と相互作用し、これを抑制することもわかってきました。レトロトランスポゾンをウイルスのように認識し撃退することによって、宿主である細胞を守っているのかもしれません。現在、質量分析を用いたL1相互作用因子の同定とその機能解明を通じて、我々のゲノム恒常性維持メカニズムについてさらに研究を行っています。このような研究の積み重ねによって、例えばレトロトランスポゾンの転移を人為的に制御する技術の確立や化合物の発見、転移によって起こり得る疾患の抑制や緩和など、発展的な可能性に応用することもできるのではないかと考えています。